新冠药竞速赛:多家医院招募新冠患者“试药” 补贴近万元?
为了加速推进新冠药的研发进展,连日来,君实生物、科兴制药、前沿生物等多家新冠治疗药物研发药企对外招募临床研究受试者。
南都记者注意到,广东、山东等地的多家医院已在公众号等平台对外发布招募信息。根据招募信息,受试者可免费体检、交通与食宿;依照实际情况给予一定额外的补贴。
也有其他临床招募相关平台发布文章显示,入选项目的患者可免费体检,交通、误工、营养补助 依从性奖励,最高补贴9450元。
多地招募新冠患者“试药”
药物临床试验是药物研发的重要内容,也是评价药物能否上市的关键环节和必经之路。
III期临床试验是对其治疗作用的确证阶段,其目的是进一步验证药物对目标适应证患者的治疗作用和安全性,评价利益和风险关系,最终为药品注册申请的审查提供充分的依据。
1月10日,南都记者从前沿生物了解到,注射用FB2001正在推进国际多中心、随机、双盲、安慰剂对照II/III期临床试验,目前受试者已入组并给药;雾化吸入用FB2001拟用于治疗轻型、普通型新型冠状病毒(SARS-CoV-2)感染患者的II/III期临床试验方案,已获得国家药品监督管理局药品审评中心同意,该临床试验为随机、双盲、安慰剂对照、平行组设计的II/III期临床研究。

前沿生物发布的受试者招募信息
根据受试者招募信息,参加试验将享有优先入院治疗资格,公立医院(获三甲医院)住院治疗,根据我国《新型冠状病毒感染诊疗方案》《新冠肺炎诊疗方案》获得标准的抗新冠病毒治疗方案;免费治疗、用药及各类指标实时监测;免费体检、交通与食宿;依照实际情况给予一定额外的补贴。
以注射用FB2001 II/III期临床试验临床研究受试者的条件为例,受试者需年龄大于等于18周岁,男女不限。中、重度住院新冠感染患者,5天内首次出现以下症状至少一项症状:发热、咳嗽、咽喉痛、乏力、头痛等,且入组前24小时内至少存在一项新冠症状。此外,出现劳力性呼吸短促、静息时气促或呼吸窘迫,需要医疗护理;呼吸频率≥20次/分钟,心率≥90次/分钟。
目前两种剂型的开发正快速推进,FB2001两种剂型的II/III期临床研究,正开展全国范围内受试者招募,据了解,开展的城市包括深圳、南京、常州、淮安、泰州、广州、邢台、镇江、北京、上海、深圳、成都、昆明、杭州、苏州、南昌等城市,目前两种剂型临床研究开展的城市名单还在不断更新中。
除此以外,“君实医学”公众号2022年12月16日发布的一篇文章显示,君实生物JT001(VV116)治疗新型冠状病毒肺炎(COVID-19)的III期临床研究招募受试者。由君实生物合资子公司上海旺实生物医药科技有限公司发起的一项在轻-中度新型冠状病毒肺炎(COVID-19)受试者中评价JT001(VV116)有效性和安全性的多中心、双盲、随机、安慰剂对照、III期临床研究(方案号:JT001-015-III-COVID-19)正在开展。本研究已获得国家药品监督管理局(批件号:CXHL2101625)和医院伦理委员会的批准,全国计划入组1200例受试者。
参与者最高补贴近万元?
据业内人士透露,临床试验环节的患者招募工作是由企业、医院、CRO公司协同推进的。
记者注意到,患者的招募和管理是临床试验中一项重要挑战,也直接关系到临床试验的速度和结果。据IQVIA最新市场调研数据表明,48%的临床研究项目受阻于不能按计划完成患者招募和入组。
在此研发的冲刺阶段,全国多地,包括山东多地医院、广州、深圳等地医院均发起对新冠阳性患者的招募,有的招募公告中甚至明确最高补贴近万元。
1月5日,一则临床招募相关的公号文章显示,一项评估GST-HG171联合Ritonavir 片在轻型/普通型新型冠状病毒肺炎COVID-19患者中的国际多中心、随机、双盲、安慰剂对照的有效性、安全性的Ⅱ/Ⅲ期临床试验,主研单位为广州医科大学附属第一医院和深圳市第三人民医院担任组长单位,共21家参研医院(覆盖广东、北京、上海、武汉、福建等),研究药品为GST-HG171片(口服小分子广谱抗新型冠状病毒3CL蛋白酶抑制剂)——具有全球自主知识产权的强效、广谱、安全性优异的抗新冠病毒3CL蛋白酶抑制剂。

最高补贴9450元
在其入选条件的下方则指出,可免费体检,交通、误工、营养补助 依从性奖励,最高补贴9450元。
记者随后与上述文章中所标注的对接人联系,对方表示,“补贴的金额属实,但是需要提供姓名与联系电话,待审核条件符合后才可加入医院的受试者名单。”对此,记者分别向相关的医院方面求证,但均表示对此不太清楚。

中山三院招募轻型或普通型新冠感染者治疗药物受试者
而在此之前,也有多家医院发布招募信息,并涉及相应的费用情况。
2022年12月13日,广州中山大学附属第三医院(以下简称“中山三院”)感染性疾病科在公众号上发布招募轻型或普通型新冠感染者治疗药物受试者。医院感染科正在开展一项“RAY1216片治疗轻型和普通型SARS-CoV-2感染患者的随机、双盲、安慰剂对照Ⅲ期临床研究(方案编号RAY1216-22-02)。”本研究计划约在全国30家中心进行,预计入选1070名轻型和普通型新型冠状 病毒感染患者。
上述通知还提到,“研究所需要的检查费用和研究药物均由申办单位承担,另外,您在参加全程29天左右的研究过程中,将获得一定的交通费、误工费补偿。”

中山三院新冠受试者招募名额已满
不过,仅仅只用了一天。12月14日,医院公告显示,新冠受试者招募名额已满,即日起停止招募。
2022年12月16日,深圳市第三人民医院I期临床试验中心发布通知称,深圳市第三人民医院感染科正在开展新冠病毒的临床试验,并对外招募新冠阳性患者,其研究产品分别为RAY1216片、F61注射液和SHEN26胶囊。

深圳市第三人民医院感染科对外招募新冠患者
有业内人士指出,在国内,目前主动报名参与临床试验的患者还是少数,提升患者主动报名参与临床试验的比例需要政府、媒体、社区、机构等各方引导。
不过,一位新冠药物研发相关药企人士在接受南都记者采访时表示,“第一波感染高峰已经过去了,大家对新冠病毒感染的认知已经不再恐慌,对治疗用药的认知也有很大提升,加之医疗资源的空间也在缓解。从企业角度来看,对于受试者招募的工作还是有利的。”
国产新冠小分子药物进入冲刺阶段
从目前的新冠口服药市场格局来看,除了Paxlovid以外,目前我国已获批的新冠口服药还包括阿兹夫定片、莫诺拉韦胶囊。
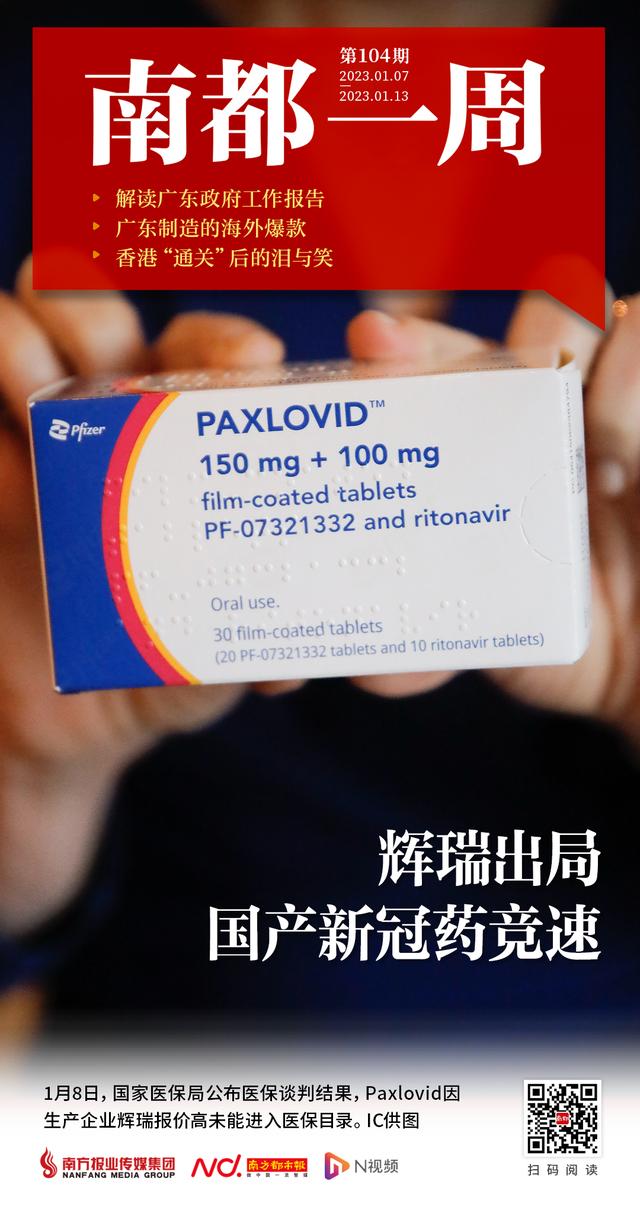
1月8日,国家医保局官网公布医保谈判结果,共有阿兹夫定片、奈玛特韦片/利托那韦片组合包装(Paxlovid)、清肺排毒颗粒3种新冠治疗药品通过企业自主申报、形式审查、专家评审等程序,参与了谈判。其中,阿兹夫定片、清肺排毒颗粒谈判成功,Paxlovid因生产企业辉瑞投资有限公司报价高未能成功。
有相关药企人士向南都记者提到,对于行业来讲,辉瑞未被纳入国家医保目录,给国内的新冠药物开发企业带来了更大的抢占市场的机会,也可以说是未来的一场晋级赛。
从研发进度来看,目前广生堂、君实生物、前沿生物、开拓药业等药企研发的新冠药物均已处于III期临床阶段,且诸多药企近日频频公布研究的进展。
1月10日,广生堂公告显示,研究结果显示公司的抗新冠病毒口服小分子一类创新药泰中定(泰阿特韦GST-HG171片/利托那韦片)具有优越的抗新冠病毒疗效,新冠患者核酸转阴时间明显优于阳性对照Paxlovid及安慰剂对照,同时安全性和耐受性良好,达到试验预期目的,为后期药物上市提供重要佐证,是公司新冠创新药研发的重大进展。公司在国家药审中心专家指导下,已全面启动泰中定的Ⅱ/Ⅲ期关键性注册临床研究,目前正在全国30余家中心招募受试者。
在此之前,1月3日,君实生物-U 发布公告称,控股子公司上海君拓生物医药科技有限公司与苏州旺山旺水生物医药有限公司合作开发的口服核苷类抗SARS-CoV-2药物VV116片(以下简称“VV116”)已完成一项对比Paxlovid用于伴有进展为重度包括死亡高风险因素的轻至中度新型冠状病毒感染患者早期治疗的III期临床研究,同时还在不同的人群中开展了多项VV116的国际多中心III期临床研究。
同日,前沿生物与中国科学院上海药物研究所、中国科学院武汉病毒研究所共同开发了抗新型冠状病毒3CL蛋白酶抑制剂FB2001(通用名:Bofutrelvir),公司拥有FB2001在全球范围内的临床开发、生产及商业化权利。目前,公司正在积极加速推进注射用FB2001拟治疗新冠病毒感染住院患者的II/III期临床试验和雾化吸入用FB2001拟治疗轻型、普通型新冠病毒感染患者的II/III期临床试验。
也有研报指出,先声药业的 3CL 抑制剂SIM0417 已经于 2022 年 12 月 18 日完成 II/III 期临床 1208 例患者入组,是进展最快的国产 3CL 小分子抑制剂,有望 2023 年初拿到临床数据并申报上市。
对于新冠口服药在新冠疫情防控中的作用,CIC灼识咨询总监刘立鹤则认为,“新冠疫情感染率的控制仍旧将以疫苗为主,未来整体新冠口服药的研发仍将以降低死亡率为首要的目标,同时最大程度上减轻症状。近期的药物研发主要以奥密克戎的特性做临床研究,而新冠病毒属于RNA病毒,基因突变的概率高,长期的变化大,未来的口服新冠药需要考虑潜在的突变毒株,进行作用机制的改进,因此也将有更多靶点的口服新冠药物加入到研发格局当中。”
采写:南都记者 伍月明